Phương pháp giải CO2 tác dụng với dung dịch kiềm
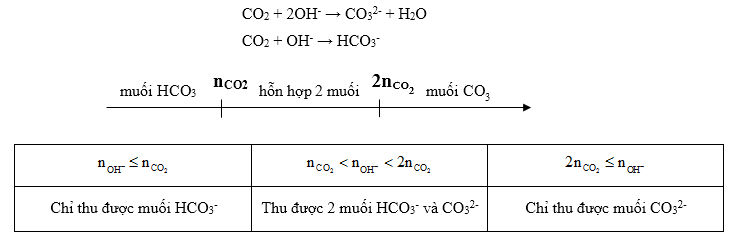
Phương pháp giải:
Trường hợp 1: nOH− ≤ nCO2 => nHCO−3 + nOH−
Trường hợp 2: nCO2 < nOH− < 2nCO2
Sử dụng bảo toàn nguyên tố C: nCO2 = nHCO−3 + nCO2−3
Sử dụng bảo toàn điện tích: nOH− = nHCO−3 + nHCO−3
=> nCO2−3 = nOH− – nCO2
Đối với những dung dịch chứa Ca2+ hoặc Ba2+ tạo kết tủa với CO32- ta cần xét 2 số mol để kết luận số mol kết tủa.
Ví dụ: nCa2+ < nCO2−3 => nCaCO3 = nCa2+
Trường hợp 3: 2nCO2 ≤ nOH− => nCO2−3 = nCO2
Phương pháp giải bài tập H+ tác dụng với dung dịch muối Cacbonat
Nhỏ từ từ dung dịch H+ vào dung dịch , và ngược lại là những dạng toán rất phổ biến trong các đề thi tuyển sinh trong những năm gần đây. Do cách giải 2 dạng toán này khác nhau nên các em cần biết để xử lí.
Trường hợp 1: NHỎ TỪ TỪ DUNG DỊCH H+ VÀO DUNG DỊCH HỖN HỢP GỒM VÀ
Nguyên tắc giải các bài toán nhỏ dung dịch H+ vào dung dịch gồm CO32−và HCO3− là trước hết CO32− sẽ nhận H+ để tạo HCO3−
CO32−+ H+→ HCO3−
Chỉ khi cho toàn bộ CO32- đã chuyển hết thành HCO3− mới xảy ra tiếp phản ứng giải phóng khí CO2
HCO3−+ H+→ CO2+ H2O
Công thức giải nhanh:
Nếu: nH+ < nHCO3− + 2nCO32− (H+ phản ứng hết) thì nCO2 = nH+ – 2nCO32−
Nếu: nH+ ≥ nHCO3− + 2nCO32− => bảo toàn C: nCO2 = nHCO3− + 2nCO32−
Trường hợp 2: NHỎ TỪ TỪ DUNG DỊCH HỖN HỢP GỒM HCO3− VÀ CO32− VÀO DUNG DỊCH H+
Do HCO3− và CO32− luôn tiếp xúc với lượng dư dung dịch H+ nên xảy ra đồng thời 2 phản ứng tạo khí CO2
nHCO3− + nH+ → nCO2 + nH2O
x x x
nCO32− + n2H+ → nCO2 + nH2O
y 2y y
Do mỗi dung dịch hỗn hợp nhỏ xuống đều chứa HCO3− và CO32− với số mol ion trong từng giọt tỉ lệ tương ứng với số mol ban đầu của mỗi ion nên để tính số mol CO2 (x + y) ta giải hệ
{xy=nHCO3−nCO32−x+2y=nH+
Công thức giải nhanh: nCO2 = nH+.(k+1)k+2 (với k = nHCO3−nCO32−)
Trung tâm tiếng Anh online HocHay: https://local.google.com/place?id=17925709090940119267&use=posts&lpsid=3791135630266163629
#HocHay #hocgioihoa12 #hoalop12 #hochoalop12 #ontaphoalop12 #baitaphoalop12 #huongdangiaibaitaphoa12 #giaibaitaphoalop12 #lythuyethoalop12 #thanhhuyenhochay #VietNam
 Cộng đồng hỏi đáp về học tiếng anh
Cộng đồng hỏi đáp về học tiếng anh